Μετά από δεκαετίες αποτυχημένων προσπαθειών, οι επιστήμονες μπορεί τελικά να βρίσκονται στο κατώφλι της ανάπτυξης θεραπειών για την αποκατάσταση της ανοσολογικής ανοχής σε παθήσεις όπως ο διαβήτης, ο λύκος και η σκλήρυνση κατά πλάκας.
Το 2001, ο ανοσολόγος Πέρε Σανταμαρία διερευνούσε έναν νέο τρόπο μελέτης του διαβήτη. Μαζί με τους συνεργάτες του ανέπτυξε μια μέθοδο που χρησιμοποιεί νανοσωματίδια οξειδίου του σιδήρου για να παρακολουθεί τα βασικά κύτταρα του ανοσοποιητικού συστήματος που εμπλέκονται στη διαταραχή. Ο Σανταμαρία χρησιμοποίησε αυτά τα σωματίδια για να στοχεύσει και να σκοτώσει τα κύτταρα που ευθύνονται για την εξέλιξη της νόσου.Σήμερα,περισσότερες από δύο δεκαετίες αργότερα, η θεραπεία θα δοκιμαστεί και σε ανθρώπους.
Οι ερευνητές προσπαθούν εδώ και περισσότερα από 50 χρόνια να «δαμάσουν» τα κύτταρα που ευθύνονται για αυτοάνοσα νοσήματα όπως ο διαβήτης τύπου 1, ο λύκος και η σκλήρυνση κατά πλάκας. Οι περισσότερες από τις εγκεκριμένες θεραπείες για αυτές τις παθήσεις λειτουργούν καταστέλλοντας ολόκληρη την ανοσολογική απόκριση. Αυτό συχνά ανακουφίζει τα συμπτώματα, αλλά καθιστά τους ανθρώπους ευάλωτους σε λοιμώξεις και καρκίνους.
Εδώ και δεκαετίες, οι ανοσολόγοι ελπίζουν να αποκαταστήσουν αυτό που είναι γνωστό ως ανοχή – την ικανότητα του ανοσοποιητικού συστήματος να αγνοεί τα αντιγόνα που ανήκουν στο σώμα, ενώ επιτίθεται σε εκείνα που δεν ανήκουν. Σε ορισμένες περιπτώσεις, αυτό σημαίνει τη χορήγηση των ίδιων των αντιγόνων στα οποία έχουν εκπαιδευτεί να επιτίθενται τα κύτταρα, μια στρατηγική που μπορεί να αμβλύνει την αυτοάνοση απόκριση. Άλλοι ερευνητές προσπαθούν να εξαλείψουν επιλεκτικά τα προβληματικά κύτταρα ή να εισάγουν κατασταλτικά ανοσοποιητικά κύτταρα που έχουν κατασκευαστεί για να τα στοχεύουν. Μια προσέγγιση που βασίζεται σε τροποποιημένα ανοσοποιητικά κύτταρα χρησιμοποιήθηκε για τη θεραπεία 15 ατόμων με λύκο ή άλλες ανοσολογικές διαταραχές με εξαιρετική επιτυχία.
Εάν τα αποτελέσματα των περαιτέρω δοκιμών σε ανθρώπους είναι θετικά, η θεραπεία αυτή θα μπορούσε να αλλάξει ζωές, δήλωσε στο επιστημονικό περιοδικό «Nature» ο Μαξιμίλιαν Κόνιγκ, ρευματολόγος στο Πανεπιστήμιο Johns Hopkins στη Βαλτιμόρη, ο οποίος ειδικεύεται στα αυτοάνοσα νοσήματα.
«Οι θεραπείες που έχουμε για αυτές τις ασθένειες δεν αποδίδουν πάντα, και ακόμη και όταν αποδίδουν, η βελτίωση είναι συχνά μέτρια», εξήγησε ο Κόνιγκ.
Το ανοσοποιητικό σύστημα είναι γνωστό για το ρόλο του στην επίθεση κατά των παθογόνων μικροοργανισμών. Έχει όμως και μια άλλη, εξίσου σημαντική δουλειά: να ξέρει πότε να σταματήσει. Εάν τα κύτταρα του ανοσοποιητικού συστήματος δουν τους ιστούς του ίδιου του σώματος ως απειλή, μπορεί να προκαλέσουν βλάβη. Το σώμα διαθέτει ένα εφεδρικό σύστημα, έναν μηχανισμό γνωστό ως «περιφερική ανοχή». Αυτός εξαλείφει τα δύστροπα κύτταρα ή τα μετατρέπει σε λεγόμενα ρυθμιστικά Τ κύτταρα, τα οποία καταστέλλουν την ανοσολογική απόκριση εμποδίζοντας άλλα κύτταρα να επιτεθούν.
Στα αυτοάνοσα νοσήματα, τόσο η κεντρική όσο και η περιφερική ανοχή καταρρέουν για λόγους που δεν είναι απολύτως κατανοητοί και το ανοσοποιητικό σύστημα αρχίζει να επιτίθεται σε αντιγόνα που βρίσκονται στα κύτταρα και τους ιστούς του ίδιου του σώματος. Στην πολλαπλή σκλήρυνση, ο οργανισμός επιτίθεται στο περίβλημα μυελίνης που μονώνει τα νεύρα. Στην κοιλιοκάκη, η γλουτένη ενεργοποιεί το ανοσοποιητικό σύστημα να επιτεθεί στον εντερικό βλεννογόνο.
Εάν οι επιστήμονες μπορούσαν να εξαλείψουν τα δυσλειτουργικά κύτταρα – αποκαθιστώντας την ανοχή σε συγκεκριμένα αντιγόνα – θα μπορούσαν να θεραπεύσουν την ασθένεια χωρίς να παρεμποδίσουν την ικανότητα του ανοσοποιητικού συστήματος να αντιδράσει σε πραγματικές απειλές. Οι πρώτες προσπάθειες επικεντρώθηκαν στη χορήγηση μεγάλων ποσοτήτων του προβληματικού αντιγόνου σε μια προσπάθεια να εξαντληθούν ή να απενεργοποιηθούν τα κύτταρα του ανοσοποιητικού συστήματος που το αναγνωρίζουν. Πολλές ερευνητικές ομάδες δοκίμασαν αυτή τη μέθοδο με διαφορετικά επίπεδα επιτυχίας. Το αντιγόνο πρέπει να εισαχθεί με τον κατάλληλο τρόπο, ώστε να ενισχυθεί η ανοχή και όχι να ενεργοποιηθεί η ανοσία, λέει ο Τζέφρι Μπλούστοουν, ανοσολόγος και διευθύνων σύμβουλος και συνιδρυτής της Sonoma Biotherapeutics στο Σαν Φρανσίσκο.
Αναζητώντας τον «διακόπτη»
Ωστόσο, η επιλογή του σωστού αντιγόνου είναι δύσκολη υπόθεση. Ορισμένα αυτοάνοσα νοσήματα προκαλούνται από αντίδραση σε ένα μόνο από αυτά. Για πολλές παθήσεις, όπως σκλήρυνση κατά πλάκας, διαβήτης και ρευματοειδής αρθρίτιδα, ο οργανισμός αναπτύσσει ανοσολογική αντίδραση έναντι πολλών αντιγόνων μέσω ενός φαινομένου που ονομάζεται «επέκταση επιτόπων» (epitope spreading). Οι ερευνητές θα μπορούσαν να προσπαθήσουν να επεξεργαστούν όλα τα αντιγόνα που εμπλέκονται, σύμφωνα με τον Μπλούστοουν. Αλλά αυτό είναι δύσκολο εγχείρημα, ειδικά επειδή μπορεί να διαφέρουν από άτομο σε άτομο. Μια άλλη πιθανότητα είναι να αναζητήσουν έναν κύριο «διακόπτη» που απενεργοποιεί την αυτοάνοση αντίδραση αφήνοντας άθικτο το ανοσοποιητικό σύστημα.
Ο Σανταμαρία πιστεύει ότι έχει βρει έναν τέτοιο μηχανισμό. Τα νανοσωματίδια της ομάδας του – τα οποία ονομάζει navacims – φέρουν πρωτεΐνες που ονομάζονται μόρια του μείζονος συμπλέγματος ιστοσυμβατότητας και προεξέχουν από την επιφάνεια του σωματιδίου σαν ακίδες. Αυτές οι ακίδες μιμούνται εκείνες που βρίσκονται στα ρυθμιστικά κύτταρα του ανοσοποιητικού συστήματος, γνωστά ως αντιγονοπαρουσιαστικά κύτταρα, τα οποία συγκεντρώνουν αντιγόνα από όλο το σώμα και τα μεταφέρουν στα Τ κύτταρα. Ο ερευνητής τα αποκαλεί «δολώματα των Τ-κυττάρων». Αφού ο ερευνητής έμαθε πώς να χρησιμοποιεί τα navacims για την παρακολούθηση των Τ κυττάρων, άρχισε να επεξεργάζεται τον τρόπο χρήσης τους ως θεραπεία. Σκέφτηκε ότι τα νανοσωματίδια θα μπορούσαν να προκαλέσουν το θάνατο ή την αδρανοποίηση των κυττάρων.
Εκείνη την εποχή, εργαζόταν με ένα μοντέλο ποντικού για διαβήτη τύπου 1, μια ασθένεια στην οποία είναι γνωστό ότι συμβαίνει επέκταση επιτόπων. Έτσι, ανέπτυξε ένα «κοκτέιλ» σωματιδίων που έφεραν οκτώ διαφορετικά τμήματα αντιγόνου. Χρησιμοποίησε επίσης ένα νανοσωματίδιο που μετέφερε έναν μόνο αντιγόνο, υποθέτοντας ότι δεν θα είχε καμία επίδραση, επειδή τα Τ-κύτταρα αναγνωρίζουν χιλιάδες αντιγόνα στον διαβήτη. Παραδόξως, όμως, τόσο τα νανοσωματίδια ελέγχου όσο και τα πειραματικά ανέστρεψαν τα συμπτώματα του διαβήτη.
Του πήρε χρόνια για να καταλάβει τι συνέβαινε, αλλά τώρα πιστεύει ότι βρήκε την εξήγηση. Τα νανοσωματίδια ωθούν τα Τ-κύτταρα να πολλαπλασιαστούν και να μετατραπούν σε ρυθμιστικά Τ-κύτταρα, τα οποία ταξιδεύουν στο σημείο της φλεγμονής. Εκεί, δεσμεύουν και απενεργοποιούν τα κύτταρα που φέρουν όχι μόνο το αντιγόνο που αναγνωρίζουν, αλλά και χιλιάδες άλλα που συνδέονται με τον διαβήτη. Έτσι, τα κύτταρα αυτά δεν μπορούν πλέον να ενεργοποιήσουν τα κύτταρα του ανοσοποιητικού συστήματος που τροφοδοτούν τη νόσο. Κατά μία έννοια, το αντιγόνο λειτουργεί ως κεντρικός διακόπτης.
Η μέθοδος αυτή δεν έχει δοκιμαστεί ακόμη κλινικά. Ο Σανταμαρία έχει ιδρύσει μια εταιρεία με την ονομασία Parvus Therapeutics στο Σαν Φρανσίσκο και αναμένεται να ξεκινήσει την πρώτη κλινική δοκιμή σε ανθρώπους φέτος, ξεκινώντας με μια αυτοάνοση ασθένεια που επηρεάζει το ήπαρ.
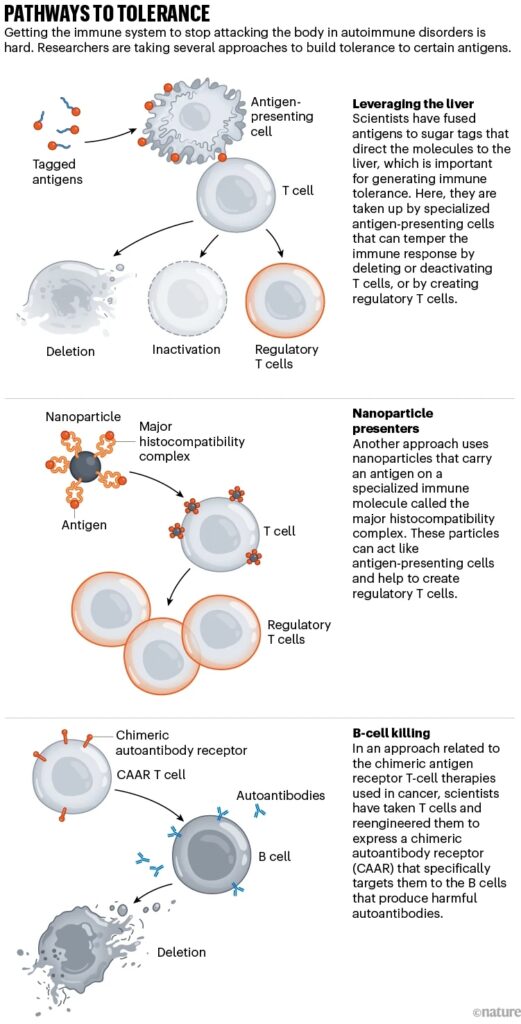
Στο ήπαρ φιλτράρεται όλο το αίμα που μεταφέρει ξένα αντιγόνα από το έντερο. Είναι επίσης ο προορισμός όλων των κυτταρικών υπολειμμάτων που μένουν όταν τα κύτταρα και οι ιστοί πεθαίνουν. Ως εκ τούτου, έχει σημαντικό ρόλο στην εδραίωση της ανοσολογικής ανοχής. Ο Τζέφρι Χάμπελ, χημικός μηχανικός στο Πανεπιστήμιο του Σικάγο στο Ιλινόι και οι συνεργάτες του, ανακάλυψαν ότι τα κυτταρικά υπολείμματα φέρουν μια ειδική «ετικέτα» σακχάρου που τα κατευθύνει στο ήπαρ. Προσθέτοντας αυτή την ετικέτα σακχάρου σε άλλες πρωτεΐνες, συνειδητοποίησαν ότι μπορούσαν να κατευθύνουν σχεδόν οποιοδήποτε μόριο ήθελαν στο ήπαρ, συμπεριλαμβανομένων αντιγόνων όπως οι πρωτεΐνες μυελίνης που ενεργοποιούν το ανοσοποιητικό σύστημα στην πολλαπλή σκλήρυνση. Σε μελέτη που δημοσιεύθηκε το 2023, έδειξαν ότι η μέθοδος αυτή λειτουργεί για την αναστροφή των συμπτωμάτων μιας νόσου που μοιάζει με σκλήρυνση κατά πλάκας, σε ποντίκια.
Αυτό που ήταν τόσο συναρπαστικό σε αυτή τη δημοσίευση, λέει ο Χάμπελ, είναι ότι τα ζώα είχαν προχωρημένη νόσο, πράγμα που σημαίνει ότι το ανοσοποιητικό τους σύστημα πιθανώς αντιδρούσε εναντίον μιας ποικιλίας αντιγόνων. Ωστόσο, η θεραπεία με ένα μόνο αντιγόνο επέφερε την αναστροφή της παράλυσης.
Μια εταιρεία που ονομάζεται Anokion στο Κέιμπριτζ της Μασαχουσέτης, την οποία συνίδρυσε ο Χάμπελ, αναπτύσσει μια παρόμοια μέθοδο. Η μέθοδος δοκιμάστηκε σε κλινική δοκιμή φάσης Ι σε άτομα με σκλήρυνση κατά πλάκας για να αξιολογηθεί η ασφάλειά της. Τώρα, η ερευνητική ομάδα αναζητά εθελοντές για την επόμενη φάση, κατά την οποία θα αξιολογηθεί η αποτελεσματικότητά της.
Ο Μπλούστοουν ακολουθεί μια διαφορετική προσέγγιση. Αυτός και οι συνάδελφοί του στη Sonoma Biotherapeutics παίρνουν Τ-κύτταρα από το αίμα των ασθενών, εξάγουν τα ρυθμιστικά κύτταρα και τα τροποποιούν ώστε να εκφράζουν ένα αντιγόνο που θα κατευθύνει τα ρυθμιστικά Τ-κύτταρα στην περιοχή της νόσου, όταν αυτά επανεισάγονται. Εκεί, θα πρέπει να είναι σε θέση να αδρανοποιήσουν όλα τα Τ κύτταρα που βρίσκονται στην περιοχή, όχι μόνο εκείνα που αναγνωρίζουν το συγκεκριμένο αντιγόνο. Η Sonoma έχει χρησιμοποιήσει ρυθμιστικά Τ κύτταρα σε κλινικές δοκιμές, αλλά όχι εκείνα που έχουν κατασκευαστεί για να εκφράζουν ένα συγκεκριμένο αντιγόνο. Σχεδιάζει να χορηγήσει την πρώτη δόση σε άτομο με ρευματοειδή αρθρίτιδα στις αρχές του 2024.
Ο ερευνητής πιστεύει ότι η προσέγγιση αυτή είναι λιγότερο επικίνδυνη από τη χορήγηση αντιγόνων σε ανθρώπους που θα μπορούσαν να επιδεινώσουν περαιτέρω την αυτοανοσία. Επίσης, τα ρυθμιστικά Τ κύτταρα παράγουν παράγοντες αποκατάστασης των ιστών, οι οποίοι θα μπορούσαν να βοηθήσουν στην αναστροφή ορισμένων ζημιών που προκαλεί η ασθένεια. Ωστόσο, οι κυτταρικές θεραπείες παρουσιάζουν και προκλήσεις, συμπεριλαμβανομένου του υψηλού κόστους και των πιθανών παρενεργειών.
Τα Β κύτταρα στο επίκεντρο του ενδιαφέροντος
Άλλοι ερευνητές αναπτύσσουν θεραπείες για την άμεση εξόντωση των ανοσοποιητικών κυττάρων που συμβάλλουν στη νόσο. Μια ομάδα στη Γερμανία δοκιμάζει μια μέθοδο που χρησιμοποιείται συνήθως για τη θεραπεία των καρκίνων του αίματος, η οποία εξοπλίζει τα κύτταρα Τ με έναν χιμαιρικό υποδοχέα αντιγόνου (CAR). Οι κλινικοί γιατροί παίρνουν Τ κύτταρα από το σώμα του ασθενούς και τα τροποποιούν ώστε να εκφράζουν αυτόν τον εξειδικευμένο συνθετικό υποδοχέα στην επιφάνειά τους. Μπορούν να δημιουργήσουν έναν CAR που συνδέεται με το CD-19, μια πρωτεΐνη που βρίσκεται σε όλα τα Β κύτταρα. Στη συνέχεια, οι γιατροί εγχέουν τα Τ-κύτταρα CAR στο σώμα, όπου αρχίζουν να επιτίθενται στα Β κύτταρα.
Μέχρι στιγμής, οι ερευνητές έχουν παρουσιάσει αποτελέσματα για συνολικά 15 άτομα: 8 με λύκο, 4 με συστηματική σκλήρυνση, η οποία επηρεάζει τον συνδετικό ιστό, και 3 με ιδιοπαθή φλεγμονώδη μυοσίτιδα, η οποία προκαλεί φλεγμονή και αδυναμία των μυών. Τα συμπτώματα των ανθρώπων βελτιώθηκαν δραματικά. Αλλά το πιο εκπληκτικό είναι ότι όλοι παρέμειναν σε ύφεση, ακόμη και αφού άρχισαν να παράγουν νέα Β κύτταρα. Με άλλα λόγια, η εξάλειψη των Β κυττάρων φαίνεται να προκάλεσε επαναφορά του ανοσοποιητικού συστήματος.
Ο Σανταμαρία υποστηρίζει ότι πολλές αποτυχίες του παρελθόντος οφείλονται στην ανεπαρκή κατανόηση των υποκείμενων μηχανισμών.
«Νομίζω ότι αποτυγχάνουν επειδή μπαίνουμε σε κλινικές δοκιμές χωρίς να ξέρουμε πραγματικά τι να κάνουμε», λέει. Μετά από 18 χρόνια έρευνας, πιστεύει ότι η μέθοδός του έχει πολλές πιθανότητες επιτυχίας.
ΠΗΓΗ: Nature

